重磅文章Nat Commun 夏元铮与孔令义团队揭示:去氧鬼臼毒素衍生物KY216通过靶向微管蛋白–VASH2互作抑制非小细胞肺癌转移

2025年12月4日,中国药科大学殷勇/孔令义/夏元铮教授团队在Nat Commun(IF 15.7)发表题为“KY216-tubulin complex captures VASH2 to inhibit NSCLC metastasis”的文章。研究解析了微管靶向药物(MTA)去氧鬼臼毒素衍生物KY216与微管蛋白的秋水仙碱结合位点结合的高分辨率 X 射线晶体结构。此外,我们证实了 KY216 在体外和体内均能有效抑制非小细胞肺癌的生长和转移。机制研究显示,KY216 通过增强 VASH2/α-微管蛋白相互作用以及增加 miR-429 水平来抑制由 VASH2/ZEB1 引起的上皮间质转化过程,从而最终限制了非小细胞肺癌的转移。
微管由两种类型的蛋白构成,即α-微管蛋白和β-微管蛋白,形成异二聚体。癌细胞的生长依赖于微管二聚体的动态聚合和解聚,这些二聚体会经历诸如去酪氨酸化、乙酰化、多聚谷氨酰胺化和多聚腺苷酸化等后翻译修饰。这些修饰存在于肿瘤组织中,并与癌细胞中的上皮-间质转化(EMT)过程相关联。针对这些动态过程的靶向治疗已被证明在开发抗肿瘤药物方面是有效的。
文章摘要
转移对非小细胞肺癌(NSCLC)患者的死亡率有显著影响。许多微管靶向药物(mta)显示出抗转移的功效,但机制尚不清楚。在本研究中,我们利用微管抑制剂KY216与αβ-微管蛋白形成晶体复合物,并说明KY216-微管蛋白结合vasohibin-2 (VASH2)抑制NSCLC转移。通过晶体结构分析,确定了KY216与弯曲微管蛋白的特定相互作用位点。KY216降低VASH2水平,阻碍非小细胞肺癌的上皮间质转化(EMT)过程。此外,MTA增强VASH2与α-微管蛋白的结合,阻止VASH2激活锌指E-box结合同源物1 (ZEB1),促进α-微管蛋白的去酪氨酸,最终抑制EMT。此外,KY216提高miR-429的水平,靶向VASH2和ZEB1转录本的3'-非翻译区(3' UTR),并通过miR-429/VASH2/ZEB1轴抑制EMT,至少部分抑制EMT,以阻断NSCLC转移。总之,我们的研究为mta和VASH2在非小细胞肺癌转移中的作用提供了有价值的见解。
KY216 能与微管蛋白结合,并形成一种复合物,该复合物会破坏微管结构,从而在 G2/M 期阻断非小细胞肺癌细胞的生长,并有效抑制其增殖。更重要的是,KY216 - 微管蛋白复合物增强了 VASH2 与α微管蛋白的相互作用,促进后者去酪氨酸化,抑制 ZEB1 的功能,并有效抑制非小细胞肺癌的转移。此外,这些效果在一定程度上还因 KY216 诱导的 miR-429 而得到增强。

1.KY216 与αβ-微管蛋白复合物的高分辨率 X 射线晶体结构
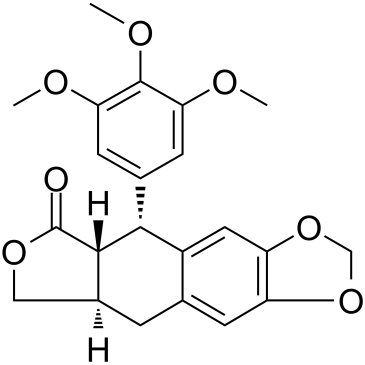
在我们之前的研究中,设计并合成了一种 N-杂环融合型脱氧鬼臼毒素(DPT)类似物 KY216,其通过靶向秋水仙碱结合位点来抑制微管聚合,并表现出强大的抗肿瘤活性(图 1a)。为了进一步探究 KY216 的作用机制,我们阐明了 KY216 与 T2R-TTL 复合物(由两个α/β-微管异二聚体、类似星状蛋白的 RB3 蛋白和微管酪氨酸连接酶组成)的结合模式,并获得了清晰且高分辨率的 X 射线晶体结构(PDB 编码为 8YRK)。
我们将晶体分辨率提高到了 2.7 Å。高分辨率的晶体结构阐明了 KY216 与微管蛋白之间的详细相互作用(图 1b)。KY216 在整个晶体中呈现出完整且均匀的电子云密度(图 1c)。KY216 占据了由β-微管蛋白的 S8、S9 和 S10 肽链、T7 循环、H7 和 H8 螺旋以及α-微管蛋白的 T5 循环所形成的秋水仙碱结合位点(图 1d)。E 环的三取代苯基氯原子紧密嵌入由β-Leu253、β-Ile368 和 β-Ala248 构成的疏水口袋中,该口袋位于秋水仙碱结合区 2 的区域内。更重要的是,氯原子通过形成卤键(灰色虚线)与βVal236 的主链羰基紧密结合,这增强了三取代苯基与β-微管蛋白之间的结合稳定性。D 环的羰基与βAsp249 肽酰胺的活性氢之间形成了典型的氢键(蓝色虚线)。在 A 环的二氧杂环烷基氢、βVal313 主链羰基、E 环取代基的烃基以及 D 环羰基与βAla248 烃基氢之间形成了三个非典型的氢键(用绿色虚线标记)(图1d)。卤键和氢键的形成不仅塑造了该化合物与微管结合的独特方式,而且显著增强了其稳定性。
通过结构重合的方式,将微管蛋白-KY216 复合物与微管蛋白-紫杉醇结构(PDB 编码为 1SA1)进行了比较。结果发现,KY216 和紫杉醇具有高度重合性,其根均方偏差(RMSD)为 0.59(733 至 733 个原子),这证实了 KY216 与微管结合模式的准确性(图 1e)。与未连接的直微管二聚体(PDB 编码为 7TQY)的重合度(RMSD = 2.319,807 至 807 个原子)表明,KY216 阻止了 T7 环相关的螺旋 H8 与中间域的β-折叠层堆叠,从而阻止了微管从弯曲构象转变为直伸构象。这种变化发生在 T7 环、螺旋 H7 和 H8 适应 KY216 的结合过程中(图 1f)。我们揭示了化合物 KY216 针对微管的特异性结合位点,为接下来的药理机制研究提供了强有力的结构基础。
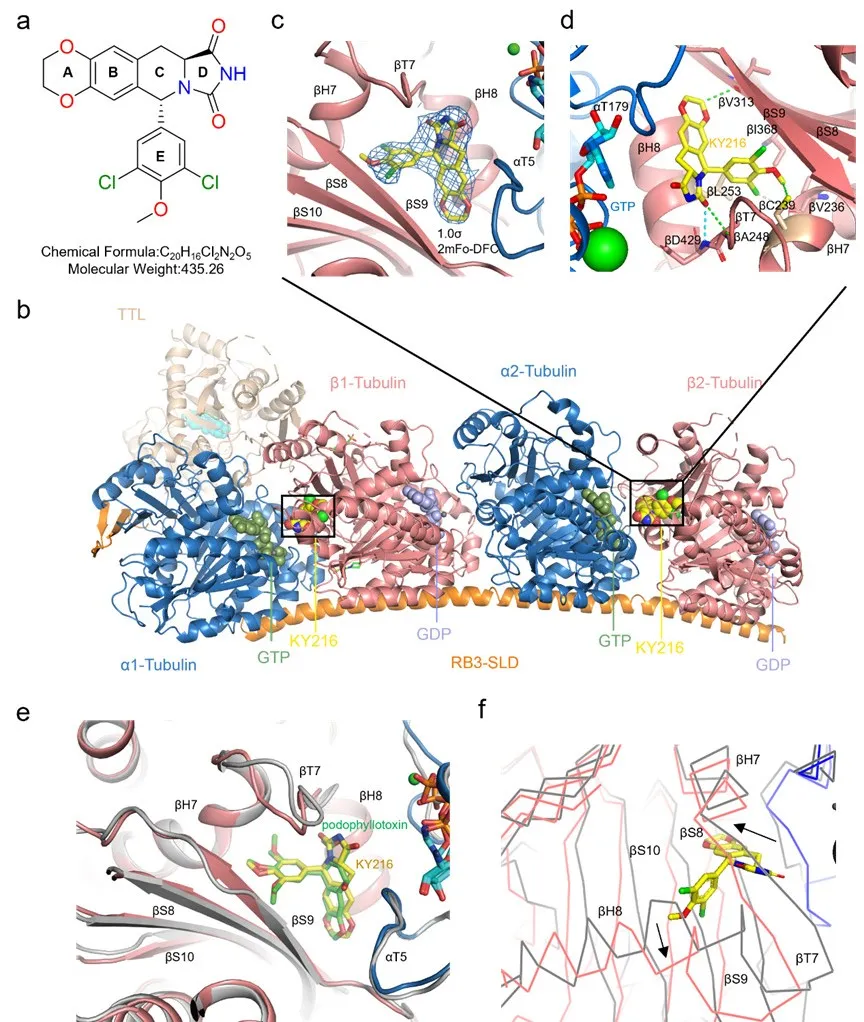
图1 KY216 与微管蛋白形成的复合物的 X 射线晶体结构,以及 KY216 与微管蛋白之间的分子相互作用
2.KY216 在体外和体内均可抑制非小细胞肺癌的进展
研究结果有力地证明了 KY216 在抑制肺癌进展以及破坏肿瘤血管方面的作用。
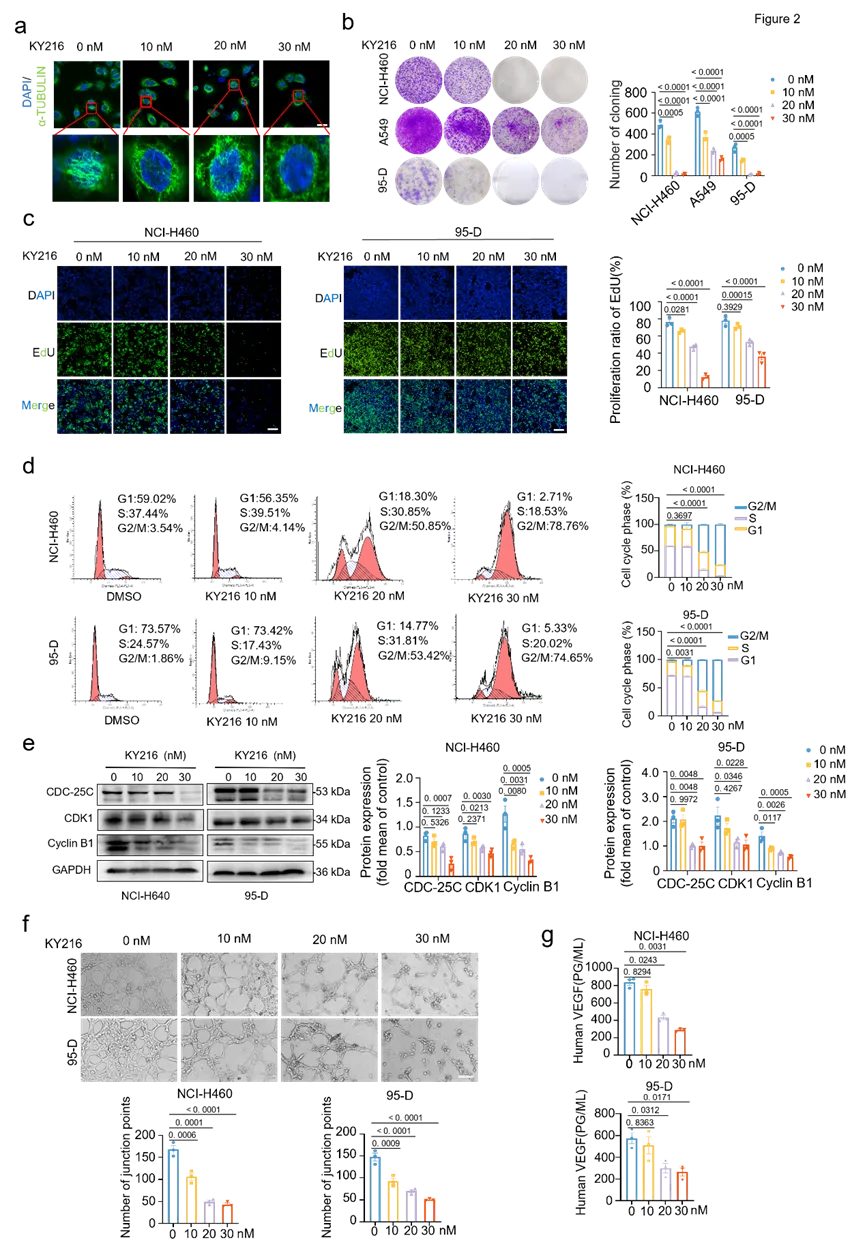
图2 KY216 能有效抑制体外培养的非小细胞肺癌的病情发展
3.KY216 能抑制高转移性肺癌细胞的侵袭和转移
KY216 对高转移性肺癌细胞的迁移和侵袭具有抑制作用。
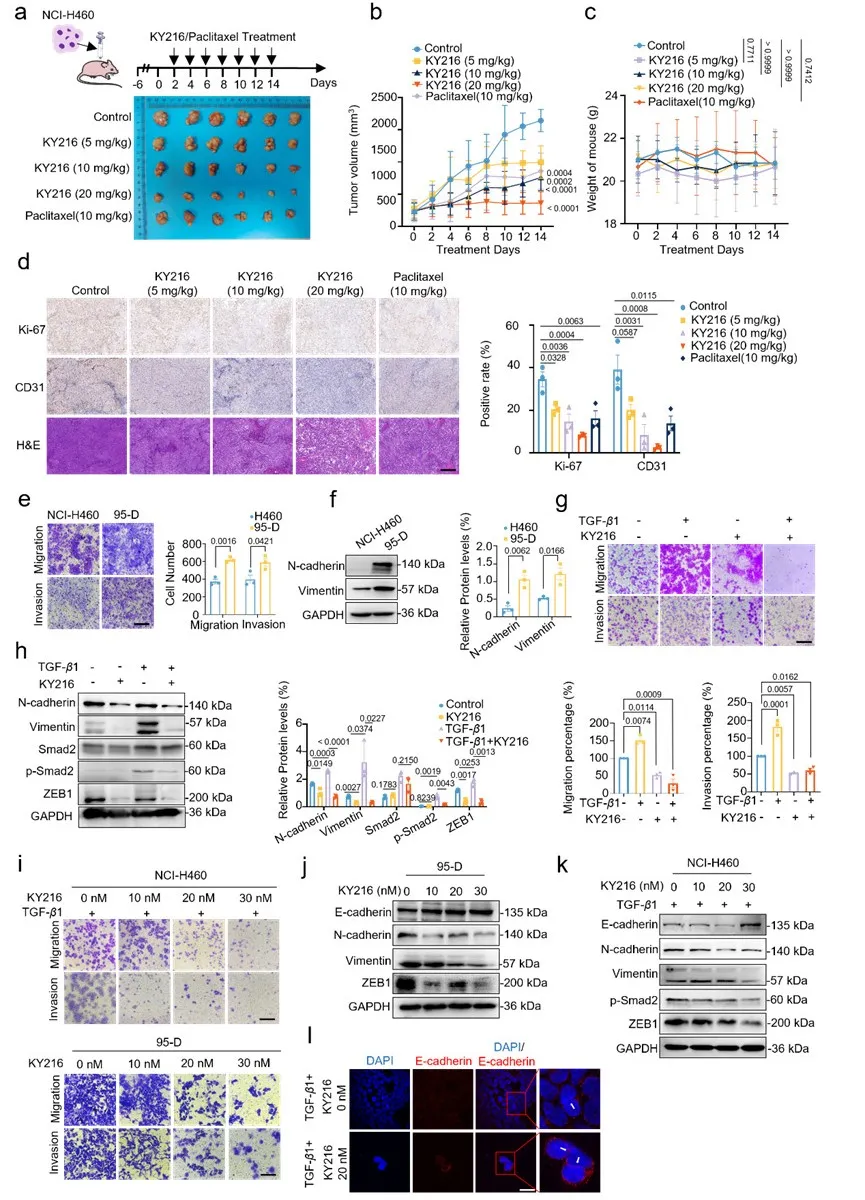
图3 KY216有效阻断NSCLC体内生长和体外转移
4.KY216通过降低VASH2抑制EMT
为了进一步阐明 KY216 的作用机制,我们收集了接受或未接受 KY216 处理的肺癌细胞样本,并进行了 RNA-seq 分析,以确定差异表达基因。在表现出显著差异表达的基因中,除了众所周知的促进转移因子 ZEB1 之外,我们还特别观察到 VASH2 的显著下调。敲低何过表达VASH2进行了进一步炎症。VASH2在抑制非小细胞肺癌转移方面所发挥的关键作用提供了有力证据,该作用由 KY216 所发挥。
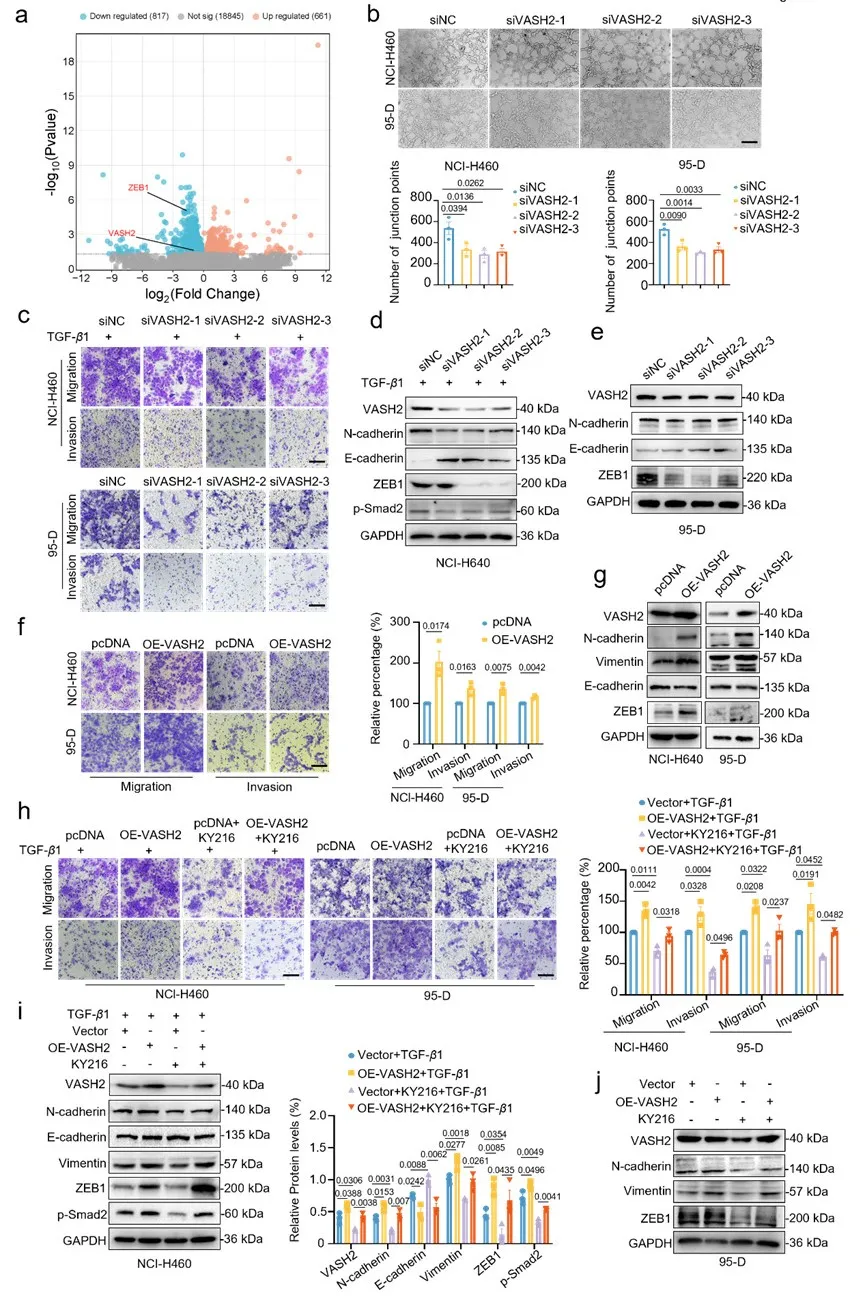
图4 KY216通过降低VASH2抑制EMT
5.KY216 通过促进 VASH2 与α-微管蛋白的结合促进微管蛋白的去酪氨酸化过程及抑制上皮间质转化(EMT)
尽管这些微管靶向药物(MTAs)都能有效地降低 VASH2 的表达,但它们对α-微管蛋白去酪氨酸化以及 VASH2 与微管蛋白的相互作用可能产生不同的调节作用,这可能是由于它们的化学结构存在差异所致。
在 KY216 的调控下,VASH2 结合、微管蛋白去酪氨酸化以及 ZEB1 的表达之间存在着密切的关联。KY216 能有效降低 VASH2 在促进上皮间质转化过程中的活性,其机制在于它能招募 VASH2,增强其与α-微管蛋白的相互作用,促进微管去酪氨酸化,并抑制 ZEB1 的表达。
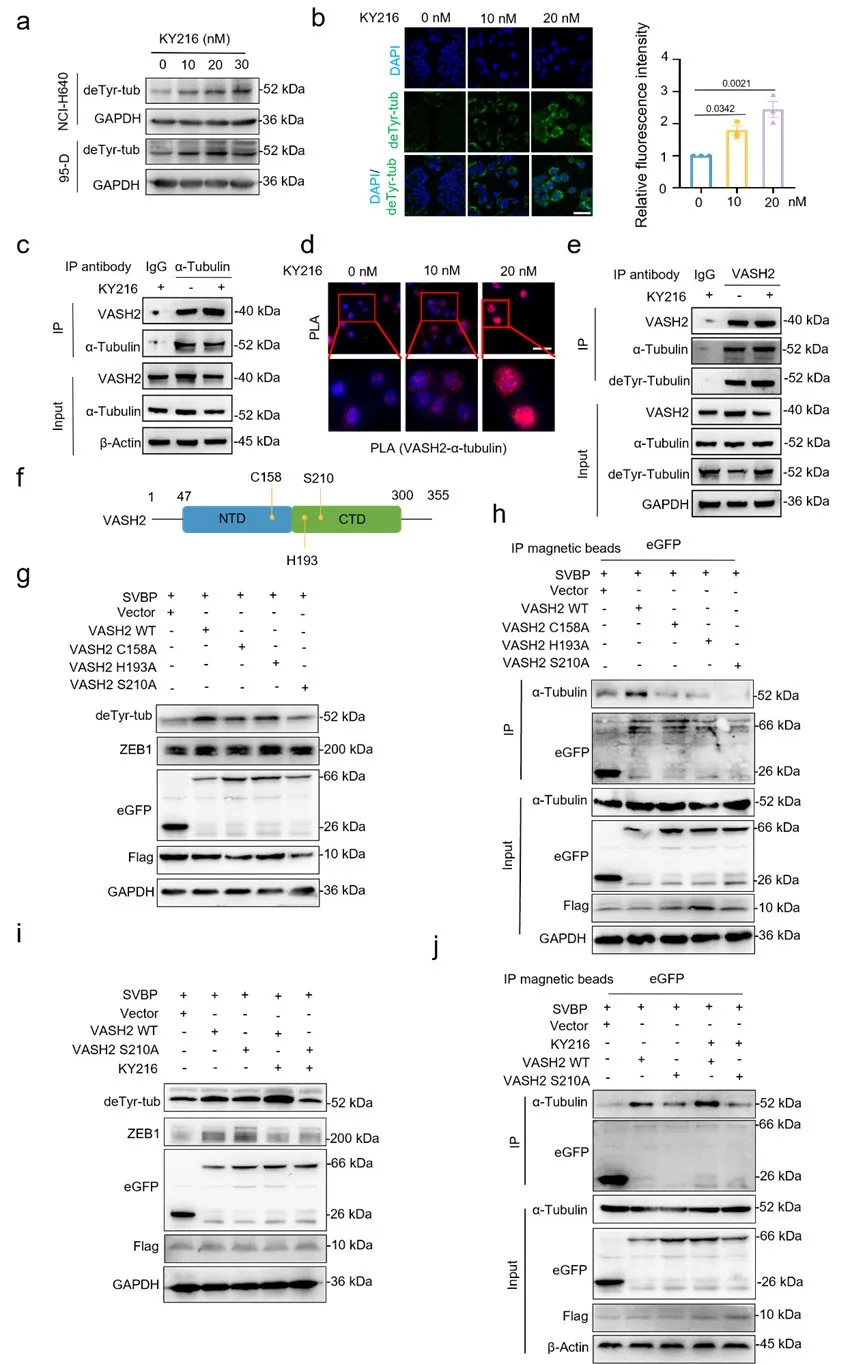
图5 KY216通过促进VASH2结合α-微管蛋白抑制EMT
6.KY216 通过 miR-429/VASH2/ZEB1 轴至少部分地抑制了上皮间质转化(EMT)过程
KY216 不仅可以通过核心调控轴来抑制上皮间质转化(EMT),还可能通过由 miR-429 介导的多靶点协同调控网络来实现这一作用。

图6 ky216诱导的miR-429通过靶向VASH2转录物抑制NSCLC转移
7.KY216 对非小细胞肺癌在体内的转移抑制作用取决于 VASH2 蛋白
VASH2 的过表达会在体内促进非小细胞肺癌的转移,并且削弱了 KY216 对转移的抑制作用。

图7 KY216对NSCLC体内转移的抑制作用依赖于VASH2
结论
KY216 能与微管蛋白结合,并形成一种复合物,该复合物会破坏微管结构,从而在 G2/M 期阻断非小细胞肺癌细胞的生长,并有效抑制其增殖。更重要的是,KY216 - 微管蛋白复合物增强了 VASH2 与α微管蛋白的相互作用,促进后者去酪氨酸化,抑制 ZEB1 的功能,并有效抑制非小细胞肺癌的转移。此外,这些效果在一定程度上还因 KY216 诱导的 miR-429 而得到增强。
张超,汉族,博士研究生,副教授,药物化学方向硕士生导师。入选皖南医学院第四批学术与技术带头人后备人选和青年骨干人才资助计划。近5年主持国家自然科学基金一项,省部级课题五项,以第一或通讯作者身份发表论文8篇,其中SCI论文6篇,MEDILINE论文2篇。














请先 登录后发表评论 ~